 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
将分析测试模拟溶液得到的各元素的浓度值,与计算的元素限度值比较,高于30%元素限度值的元素,则需在浸出物研究中进行监测()
 答案
答案
是
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 答案
答案
是
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“将分析测试模拟溶液得到的各元素的浓度值,与计算的元素限度值比…”相关的问题
更多“将分析测试模拟溶液得到的各元素的浓度值,与计算的元素限度值比…”相关的问题
芒硝化学式为Na2SO4·10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。用如图所示装置电解硫酸钠溶液,模拟工业上离子交换膜法制烧碱的方法。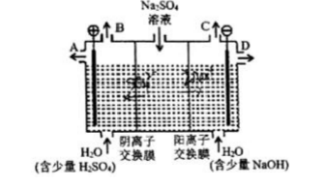 (1)该电解槽的阴极反应式为()。
(1)该电解槽的阴极反应式为()。
(2)电解时,通过阴离子交换膜的离子数()通过阳离子交换膜的离子数。(填大于、小于或等于)。
(3)制得的氢氧化钠溶液从出口()(填写“A”、“B”、“C”、“D”)导出。
(4)①若将制得的氧气、氢氧化钠溶液与天然气组合为甲烷燃料电池,则电池负极的电极反应式为()。
②若将该电池连接两惰性电极,用于电解800mLlmol/L的AgNO3溶液,当原电池中消耗CH4的体积在标况下为0.224L时,电解池中阴极将得到()g的单质,电解池中H+的浓度为()(假设溶液体积不变)。
A.73.3 %
B.74.4%
C.75.0%
D.76.8%
A.将40 g 氢氧化钠溶解于1 L水中
B.将22.4 L氯化氢气体溶于水配成1 L溶液
C.将1 L 10 mol·L-1 的浓盐酸与9 L水混合
D.将10.6 g碳酸钠溶解于水得到100 mL溶液
海洋中蕴含丰富的资源,下图涉及多个以海水为原料的生产流程。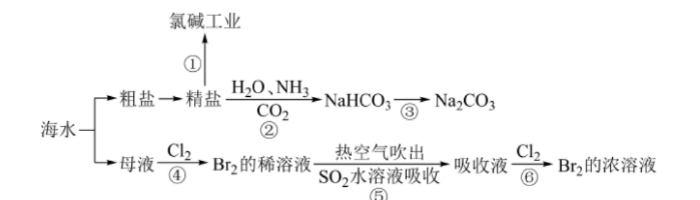 完成下列填空:
完成下列填空:
(1) 步骤①中电解饱和食盐水的化学方程式是()。
(2)工业上用Cl2与KOH(热溶液)制备KClO3,,Cl2+KOH=KCl+KClO3+H2O。配平上述反应方程式,并标出电子转移方向和数目()。
(3)关于卤素的下列说法错误的是()。
A、单质的熔点:Cl2>Br2>I2
B、元素的非金属性:Cl>Br>I
C、单质的氧化性:I2>Br2>Cl2
D、从海洋中获得Cl2,Br2的过程均涉及氧化还原反应
(4)对图中所示生产过程的说法正确的是()。
A、溶解度:NaHCO3>Na2CO3
B、第④⑤⑥步骤中,溴元素均被还原
C、第⑤⑥步骤的目的是进行溴的富集,提高Br2的浓度
D、联碱法与氨碱法相比,NaCl利用率较高,且能耗低
(5)步骤②是在饱和食盐水中先通入NH3再通入CO2,原因是()。
(6)某同学将CO2通入NaOH溶液中,当溶液呈中性时,溶液中浓度最大的微粒是()。
A、c(Na+)B、c(CO32-)C、c(HCO3-)D、c(H+)
A.乙醚起萃取剂的作用
B.反应终点时,溶液呈现蓝紫色,根据颜色深浅比色定量
C.反应中需通过滴加氢氧化钠,将反应体系pH值调节到14左右
D.在分液漏斗中,乙醚层在下,水层在上
以黄铁矿为原料制硫酸产生的废渣中含Fe2O3、SiO2、Al2O3、CaO、MgO等。现以此废渣制备铁红(Fe2O3)的过程如下。此浓度时,部分阳离子以氢氧化物形式沉淀时溶液的pH由见右表。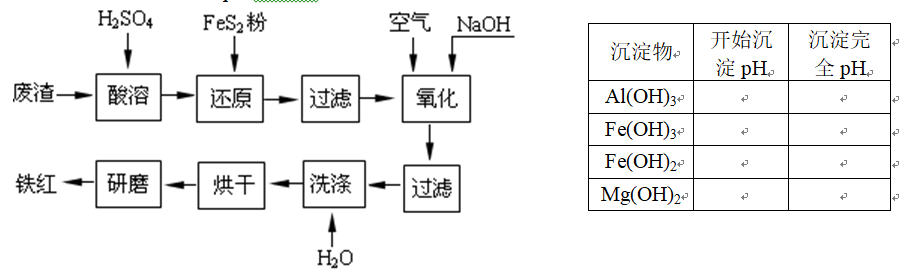 问题一、酸溶过程中Fe2O3与稀硫酸反应的化学方程式是()。
问题一、酸溶过程中Fe2O3与稀硫酸反应的化学方程式是()。
问题二、复原过程中加入FeS2是将溶液中的Fe3+复原为Fe2+,而本身被氧化为SO42-,写出有关的离子方程式:()。
问题三、氧化过程中通入空气和加入NaOH是为了将溶液中的铁元素充分转化为沉淀而析出,写出有关的离子方程式:()。
问题四、为了确保铁红的质量,氧化过程需要调节溶液pH的范围为()≤pH<()。
问题五、假设NaOH加入过量,所的铁红产品中有其它杂质,但可能无Al2O3,其原因是(用离子方程式表示):() 。
工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: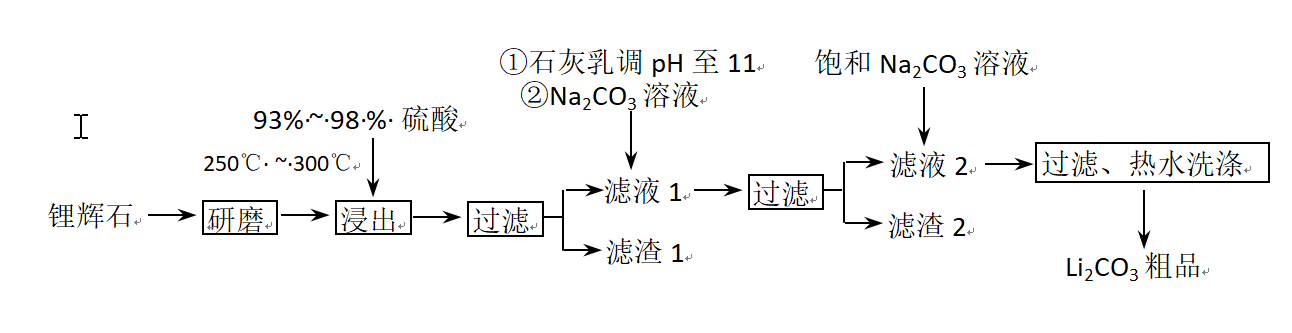 已知:①
已知:①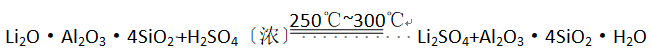 ②某些物质的溶解度(S)如下表所示
②某些物质的溶解度(S)如下表所示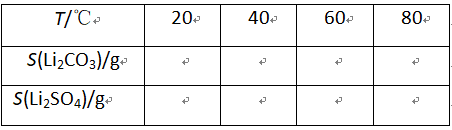
问题一、从滤渣1中别离出Al2O3的部分流程如以下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是()。
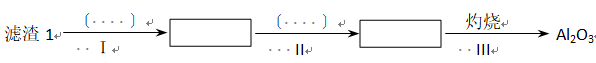
问题二、已知滤渣2的主要成分有Mg(OH)2和CaCO3向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)()
问题三、向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是()
问题四、工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下()
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3
①a中,阳极的电极反应式是()。
②b中,生成Li2CO3反应的化学方程式是()。