 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知含A和B的溶液,在较大的浓度范围内服从比尔定律,不同波长的摩尔吸光系数如下: λ/nm εA/L·mol
已知含A和B的溶液,在较大的浓度范围内服从比尔定律,不同波长的摩尔吸光系数如下:
| λ/nm | εA/L·mol-1·cm-1 | εB/L·mol-1·cm-1 |
| 440 | 965 | 0.00 |
| 540 | 574 | 428 |
| 600 | 167 | 1178 |
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知含A和B的溶液,在较大的浓度范围内服从比尔定律,不同波长的摩尔吸光系数如下:
| λ/nm | εA/L·mol-1·cm-1 | εB/L·mol-1·cm-1 |
| 440 | 965 | 0.00 |
| 540 | 574 | 428 |
| 600 | 167 | 1178 |
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知含A和B的溶液,在较大的浓度范围内服从比尔定律,不同波长…”相关的问题
更多“已知含A和B的溶液,在较大的浓度范围内服从比尔定律,不同波长…”相关的问题
0.10mol·L-1AgNO3溶液50mL,加入相对密度为0.932、含NH318.24%的氨水30mL后,加水稀释至100mL,求此溶液中Ag+,[Ag(NH3)2]+和 NH3的浓度。
(已知[Ag(NH3)2]+的K稳=1.7×107)
A.设置一系列温度梯度,确定淀粉酶活性较强的温度范围
B.将淀粉酶溶液、淀粉溶液混合后再进行保温处理
C.通过观察加入碘液后不同温度下溶液颜色的变化可确定酶活性的强弱
D.混合保温一段时间后,在保温装置中直接加碘液即可检测淀粉水解情况
十二水合硫酸铝钾[KAI(SO4)2・12H2O]俗名明矾,在生活、医药、工业上应用广泛。下面是实脸室探究从铝土矿(主要成分是氧化铝,含少量氧化铁和二氧化硅杂质)制备明矾的流程示意图。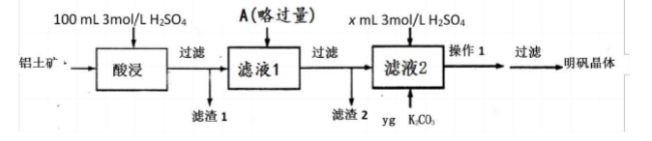 已知:二氧化硅不溶于水,也不与硫酸反应。
已知:二氧化硅不溶于水,也不与硫酸反应。
(1)铝元素在地壳中以()态存在,写出KAl(SO4)·12H2O溶于水的电离方程式()。当明矾溶液中混有NaCl时,简述如何检验Cl()。
(2)滤渣1主要为()(填化学式);以Al2O3为原料,制备该单质铝的反应方程式()。
(3)若A为金属单质,则滤渣2的成分有()。
(4)操作1是蒸发溶剂至有大量晶膜、冷却结晶。实验室进行该操作时,需要的实验仪器有铁架台、()。
(5)如图为某硫酸试剂瓶的标签。若用其配制100mL3mol/L的溶液,需该硫酸()mL(含ρ的表达式)。若此硫酸物质的量浓度为c1,35%的硫酸物质的浓度为c2,则c1()2c2(填大于,小于或等于)。 (6)工业生产中,获取明矾晶体后的母液应该()(填序号)。
(6)工业生产中,获取明矾晶体后的母液应该()(填序号)。
A、弃去
B、返回酸浸流程重复利用
C、返回滤液1重复利用
D、返回滤液2重复利用
锰酸锂离子蓄电池是第二代锂离子动力电池。一种以软锰矿浆(主要成分为MnO2,含少量FeO、A1A、Si02等杂质)为原料制备锰酸锂的流程如下图所示。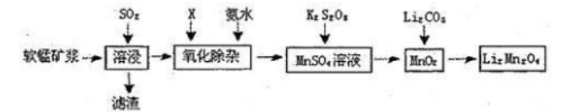 (1)溶浸生产中为提高SO2吸收率可采取的措施有()(填序号)。
(1)溶浸生产中为提高SO2吸收率可采取的措施有()(填序号)。
A、不断搅拌,使SO2和软锰矿浆充分接触
B、增大通入SO2的流速
C、减少软锰矿浆的进入量
D、减小通入SO2的流速
(2)已知:室温下,Ksp[A1(OH)3]=1×10-33,,Ksp[Fe(OH)3]=l×10-39,pH=7.1时Mn(OH)2开始沉淀。氧化除杂时(室温)除去MnSO4液中的Fe3+,Al3+(使其浓度小于1×l06mol.L-1),需调节溶液范围为()。
(3)由硫酸锰与K2S2(V溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)。请写出发生反应的离子方程式()。
(4)将MnO2和Li2O3按4:1的物质的量比配料,混合搅拌,然后升温至600℃〜750℃,制取产品LiMn2O4。写出该反应的化学方程式()。
(5)锰酸锂可充电电池的总反应为:Li1-xMn2O4+LixC LiMn2O4+C(0
LiMn2O4+C(0
<x<1)
①充电时,电池的阳极反应式为(),若此时转移lmole-,则石墨电极将增重g。
②废旧锰酸锂电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是()。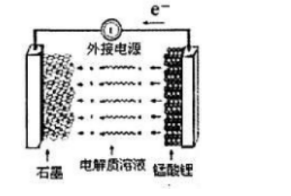
随着工业的迅速发展,产生的废水对水体的污染也日趋严重。通过控制溶液的pH对工业废水中的金属离子进行别离是实际工作中经常使用的方法。下表是常温下金属氢氧化物的Ksp(沉淀溶解平衡常数)和金属离子在某浓度下开始沉淀所需的pH(表中浓度为相应pH时溶液中有关金属离子产生沉淀的最小浓度;当溶液中金属离子浓度小于10-5mol•L-1时通常认为该离子沉淀完全)。 问题一、某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1mol•L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是()。
问题一、某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1mol•L-l。为除去其中的Fe3+,回收铜,需控制的pH范围是()。
问题二、为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加人适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准
①Cr2O72-转变为Cr3+的离子方程式为()。
②pH对废水中Cr2072-去除率的影响如右图。你认为电解过程中溶液的pH取值在()范围内对降低废水中的铬含量最有利,请说明理由:()。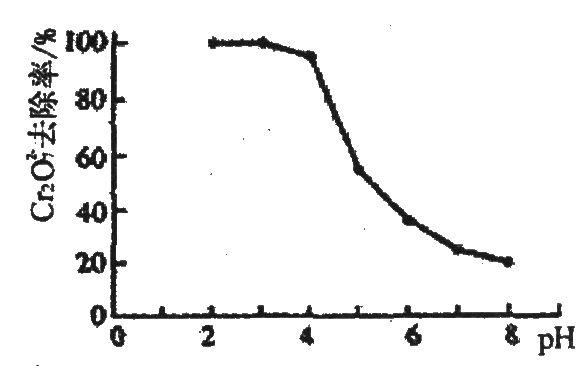
问题三、沉淀转化在生产中也有重要应用。例如,用Na2C03溶液可以将锅炉水垢中的CaS04转化为较疏松而易清除的CaC03,该沉淀转化到达平衡时,其平衡常数K=()。(已知Ksp(CaS04)=9.1x10-6,Ksp(CaC03)=2.8x10-9)
在某电导池中先后充以浓度均为0.001mol·dm-2的HCl、NaCl和NaNO3,分别测得电阻为468Ω、1580Ω和1650Ω。已知NaNO3溶液的摩尔电导率Am(NaNO3)=1.21×10-2S·m2·mol-1,设这些都是强电解质,其

 (Ag2CrO4)=1.1×10-12,在0.10mol·L-1Ag+溶液中,要产生Ag2CrO4沉淀,
(Ag2CrO4)=1.1×10-12,在0.10mol·L-1Ag+溶液中,要产生Ag2CrO4沉淀, 的浓度至少应大于( )
的浓度至少应大于( )A.1.1×10-10mol·L-1
B.2.25×10-11mol·L-1
C.0.10mol·L-1
D.1×10-11mol·L-1
A.0.75 L
B.0.336 L
C.1.5 L
D.0.448 L