 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
根据下列反应(假设离子浓度均为1.0molL-1) Ni(s)+Sn2+(aq)=Ni2+(aq)+Sn(s) Cl2(g)+2Br
根据下列反应(假设离子浓度均为1.0molL-1) Ni(s)+Sn2+(aq)=Ni2+(aq)+Sn(s) Cl2(g)+2Br-1(aq)=Br2(l)+2Cl-(aq) 试分别计算: (1)它们组成的原电池电动势,并指出正负极。 (2)298K时的平衡常数。 (3)298K反应的标准吉布斯函数变△rGΘm。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“根据下列反应(假设离子浓度均为1.0molL-1) Ni(s…”相关的问题
更多“根据下列反应(假设离子浓度均为1.0molL-1) Ni(s…”相关的问题
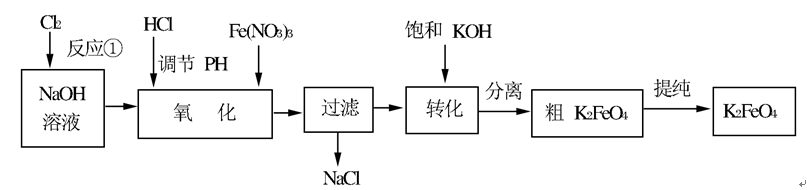 问题一、写出反应①的离子方程式()。
问题一、写出反应①的离子方程式()。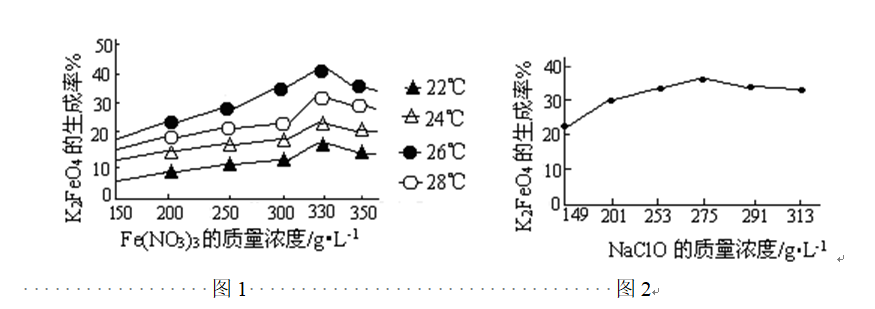
 4Fe(OH
4Fe(OH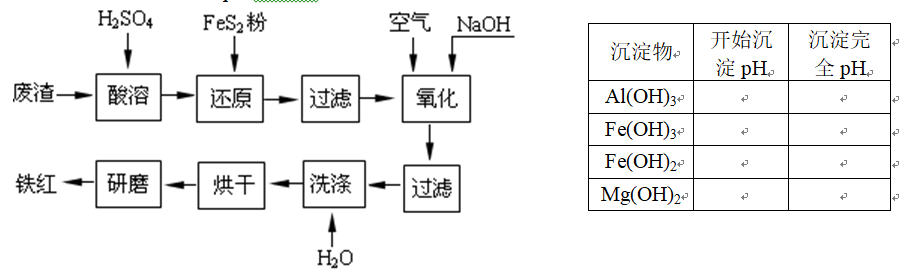 问题一、酸溶过程中Fe2O3与稀硫酸反应的化学方程式是()。
问题一、酸溶过程中Fe2O3与稀硫酸反应的化学方程式是()。















