 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知下列标准电极电势:EΘ(Cu2+/Cu)=0.340V,EΘ(Cu2+/Cu+)=0.159V,Ksp(CuCl)=1.72×10-7,试计算下列
已知下列标准电极电势:EΘ(Cu2+/Cu)=0.340V,EΘ(Cu2+/Cu+)=0.159V,Ksp(CuCl)=1.72×10-7,试计算下列反应的标准平衡常数: (1)Cu2++Cu=2Cu+; (2)Cu2++Cu+2Cl-=2CuCl(s)。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“已知下列标准电极电势:EΘ(Cu2+/Cu)=0.340V,…”相关的问题
更多“已知下列标准电极电势:EΘ(Cu2+/Cu)=0.340V,…”相关的问题
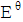 最大的是( )
最大的是( )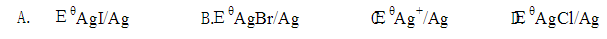
 (Cu2+/Cu)=0.3419V,
(Cu2+/Cu)=0.3419V,















