 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
计算298K时,如下反应的标准摩尔Gibbs自由能变化值和标准平衡常数。已知298 K时,HI、H2、I2、的有
计算298K时,如下反应的标准摩尔Gibbs自由能变化值和标准平衡常数。
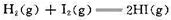
已知298 K时,HI、H2、I2、的有关数据如下:

 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
计算298K时,如下反应的标准摩尔Gibbs自由能变化值和标准平衡常数。
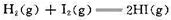
已知298 K时,HI、H2、I2、的有关数据如下:

 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“计算298K时,如下反应的标准摩尔Gibbs自由能变化值和标…”相关的问题
更多“计算298K时,如下反应的标准摩尔Gibbs自由能变化值和标…”相关的问题
对于生命起源问题,有人提出最初植物或动物的复杂分子是由简单分子自动形成的。例如,尿素(NH2CONH2)的生成可用反应方程式表示如下: CO2(g)+2NH3(g)→(NH2)2CO(s)+H2O(1) (1)计算上述反应在298K时的标准摩尔自由能变,说明反应在298K、标准状态下能否自发进行。 (2)在标准状态下,最高温度为何值时,反应就不再自发进行了? CO2(g)+2NH3(g)→(NH2)2CO(s)+H2O(1)
已知298K时,正辛烷C8H18(g)的标准摩尔燃烧焓为 -5512.4kJ.mol-1,二氧化碳CO2(g)和水H2O(1)的标准摩尔生成焓分别为393.5和-285.8mol-1;正辛烷C8H18(g)、氢气H2(g)和石墨C(s)的标准摩尔熵分别为463.71、130.68和5.74J.K-1.mol-1,计算 (1)298K时C8H18(g)生成反应的
1.jpg) (2)298K及标准压力下该生成反应达到平衡时C8H18(g)的摩尔分数; (3)讨论温度和压力对C8H18(g)生成反应的影响。
(2)298K及标准压力下该生成反应达到平衡时C8H18(g)的摩尔分数; (3)讨论温度和压力对C8H18(g)生成反应的影响。
在298K时,下述电池的电动势E=0.1519V:
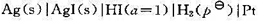
并已知下列物质的标准摩尔生成焓:
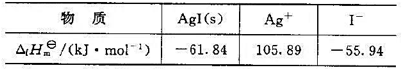
试求:(1)当电池可逆输出1mol电子的电荷量时,Q.W.(膨胀功)、W:(电功)和电池反应的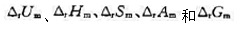 、 和 的值各为多少;(2)如果让电池短路,不做电功,则在发生同样的反应时上述各函数的变量又为多少。
、 和 的值各为多少;(2)如果让电池短路,不做电功,则在发生同样的反应时上述各函数的变量又为多少。
298K时,已知
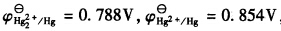 ,试计算:(1)反应Hg2++2e→
,试计算:(1)反应Hg2++2e→
 Hg22+的标准电极电势;(2)为反应Hg+Hg2+→Hg22+设计电池,并计算该反应的标准平衡常数。
Hg22+的标准电极电势;(2)为反应Hg+Hg2+→Hg22+设计电池,并计算该反应的标准平衡常数。
有人尝试用甲烷和苯为原料来制备甲苯
CH4(g)+C6H6(g)→C6H5CH3(g)+H2(g)
通过不同的催化剂和选择不同的温度,但都以失败而告终。而在石化工业上,是利用该反应的逆反应,使甲苯加氢来获得苯。试通过如下两种情况,从理论上计算平衡转化率。
(1)在500K和100kPa的条件下,使用适当的催化剂,若原料甲烷和苯的摩尔比为1:1,用热力学数据估算一下,可能获得的甲苯所占的摩尔分数;
(2)若反应条件同上,使甲苯和氢气的摩尔比为1:1,请计算甲苯的平衡转化率。
已知500K时这些物质的标准生成Gibbs自由能分别为
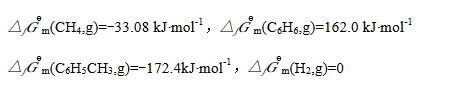
298K时,已知NaOH、NaCl和NH4Cl溶液无限稀释时的摩尔电导率分别为248.41×10-4S·m2/mol、126.4×10-4S·m2/mol和149.8×10-4S·m2/mol,试计算该温度下NH3·H2O溶液的无限稀释摩尔电导率。
CO2与H2S在高温下有如下反应:CO2(g)+H2S(g)==COS(g)+H2O(g),今在610K时,将4.4×10-3kg的CO2加入2.5dm3体积的空瓶中然后再充入H2S使总压为1000kPa。平衡后水的摩尔分数为0.02。同上试验,在620K,平衡后水的摩尔分数为0.03(计算时可假定气体为理想气体)。 (1)计算610K时的KpΘ。 (2)求610K时的△rGmΘ。 (3)计算反应的热效应△rHmΘ。
根据下列反应(假设离子浓度均为1.0molL-1) Ni(s)+Sn2+(aq)=Ni2+(aq)+Sn(s) Cl2(g)+2Br-1(aq)=Br2(l)+2Cl-(aq) 试分别计算: (1)它们组成的原电池电动势,并指出正负极。 (2)298K时的平衡常数。 (3)298K反应的标准吉布斯函数变△rGΘm。
将1mol固体I2(s)从298K、100kPa的始态,转变为457K、100kPa的I2(g),计算在457K时I2(g)的标准摩尔熵和过程的熵变。已知I2(s)在298K、100kPa时的标准摩尔熵Sm(I2,s,298K)=116.14J·mol-1·K-1,熔点为387K,标准摩尔熔化热△fusHm(I2,s)=15.66kJ·mol-1。设在298~387K的温度区间内,固体与液体碘的摩尔定压热容分别为Cp,m(I2,s)=54.68J·mol-1·K-1,Cp,m(I2,l)=79.59J·mol-1·K-1,碘在沸点457 K时的摩尔汽化热△vapHm(I2,l)=25.52kJ·mol-1。