 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知298K时,有Zn(s)+1/2O2(g)=ZnO(s),ΔrHmθ═-351.5kJ•mol-1,Hg(l)+1/2O2(g)=HgO(s),ΔrHmθ═-90.8kJ•mol-1,则反应Zn(s)+HgO(s)=Hg(l)+ZnO(s)的ΔrHmθ为()
A.442.3kJ•mol<sup>-1</sup>
B.260.7kJ•mol<sup>-1</sup>
C.–442.3kJ•mol<sup>-1</sup>
D.-260.7kJ•mol<sup>-1</sup>
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“已知298K时,有Zn(s)+1/2O2(g)=ZnO(s)…”相关的问题
更多“已知298K时,有Zn(s)+1/2O2(g)=ZnO(s)…”相关的问题

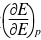 为-4.92×10-4V/K,试写出电池反应并计算当电池有2mol电子电量输出时,电池反应的△rGm、△rSm、△rHm及电池的可逆热Qr。
为-4.92×10-4V/K,试写出电池反应并计算当电池有2mol电子电量输出时,电池反应的△rGm、△rSm、△rHm及电池的可逆热Qr。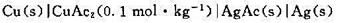
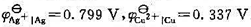 . (1)写出电极反应和电池反应;(2)当电池可逆地输出2mol电子的电荷量时,求电池反应的
. (1)写出电极反应和电池反应;(2)当电池可逆地输出2mol电子的电荷量时,求电池反应的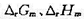 和
和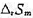 ;(3)求醋酸银AgAc(s)的溶度积
;(3)求醋酸银AgAc(s)的溶度积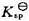 ,设活度因子均为1。
,设活度因子均为1。
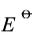 。已知298K时水的离子积Kw=1×10-14。
。已知298K时水的离子积Kw=1×10-14。1.jpg) (2)298K及标准压力下该生成反应达到平衡时C8H18(g)的摩尔分数; (3)讨论温度和压力对C8H18(g)生成反应的影响。
(2)298K及标准压力下该生成反应达到平衡时C8H18(g)的摩尔分数; (3)讨论温度和压力对C8H18(g)生成反应的影响。















