 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
298K时,反应Zn+Sn4+(1.0mol·dm-3)=Sn2++Zn2+(1.0mol·dm-3)组装成原电池,测得电动势为0,则c(Sn2+)应为()mol·dm-3。(已知ψϴ(Zn2+/Zn)=-0.76V,ψϴ(Sn4+/Sn2+)=0.15V)
A、1.0
B、4.25×10-16
C、1.81×10-31
D、0.86
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A、1.0
B、4.25×10-16
C、1.81×10-31
D、0.86
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“298K时,反应Zn+Sn4+(1.0mol·dm-3)=S…”相关的问题
更多“298K时,反应Zn+Sn4+(1.0mol·dm-3)=S…”相关的问题
在298K反应BaCl2·H2O(s)====BaCl2(s)+H2O(g)达平衡时,p(H2O)=330Pa。则反应的ΔrGθm为( )kJ·molq-1。
(A) -14.2 (B) 14.2 (C) 142 (D) -142
298K时,已知
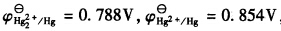 ,试计算:(1)反应Hg2++2e→
,试计算:(1)反应Hg2++2e→
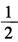 Hg22+的标准电极电势;(2)为反应Hg+Hg2+→Hg22+设计电池,并计算该反应的标准平衡常数。
Hg22+的标准电极电势;(2)为反应Hg+Hg2+→Hg22+设计电池,并计算该反应的标准平衡常数。
反应N2O5→2NO2+1/2O2在298K时的速率常数为3.46×10-5s-1,在318K时的速率常数为4.98×10-4s-1,则308K时的反应速率常数为()10-4s-1。(保留两位小数)
计算298K时,如下反应的标准摩尔Gibbs自由能变化值和标准平衡常数。
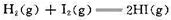
已知298 K时,HI、H2、I2、的有关数据如下:

有一酸催化反应 ,已知该反应的速率公式为
,已知该反应的速率公式为
当[A]0=[B]0=0.01mol·dm-3,在pH=2的条件下,298K时的反应半衰期为1h,若其他条件均不变,在288K时t1/2=2h。试计算在298 K时,
蔗糖水解反应
C12H22O11+H2O→2C6H12O6
活化能Ea=110kJ·mol-1;298K时其半衰期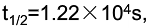
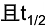 与反应物浓度无关。
与反应物浓度无关。
(1) 试问此反应的反应级数;
(2) 试写出其速率方程;
(3) 试求308K时的速率常数k.
写出下列电池的电池反应: Cd(s)|Cd2+(a=0.01)|Cl-(a=0.5)|Cl2(100kPa)|Pt,并计算298K时,各电极的电极电势及电池电动势,根据计算结果指出此电池反应能否自发进行?
已知298K时,正辛烷C8H18(g)的标准摩尔燃烧焓为 -5512.4kJ.mol-1,二氧化碳CO2(g)和水H2O(1)的标准摩尔生成焓分别为393.5和-285.8mol-1;正辛烷C8H18(g)、氢气H2(g)和石墨C(s)的标准摩尔熵分别为463.71、130.68和5.74J.K-1.mol-1,计算 (1)298K时C8H18(g)生成反应的
1.jpg) (2)298K及标准压力下该生成反应达到平衡时C8H18(g)的摩尔分数; (3)讨论温度和压力对C8H18(g)生成反应的影响。
(2)298K及标准压力下该生成反应达到平衡时C8H18(g)的摩尔分数; (3)讨论温度和压力对C8H18(g)生成反应的影响。
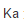 =1.76×10-5,反应HAc(1mol·L-1)====H+(0.05mol·L-1)+Ac-(0.02mol·L-1)
=1.76×10-5,反应HAc(1mol·L-1)====H+(0.05mol·L-1)+Ac-(0.02mol·L-1)A.正反应自发;
B.逆反应自发;
C.处于平衡状态;
D.速率极慢。
若 298K 时反应N2O4 (g) = 2NO2(g) 的 Kө =0.1132,则当 N2O4 和 NO2 的分压均为1.0 kPa 时, 该反应()
A向生成 NO2 的方向进行
B向生成 N2O4 的方向进行
C正好达到化学平衡
D难于判断其进行方向