 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知298K时,HAc的离解平衡常数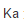 =1.76×10-5,反应HAc(1mol·L-1)====H+(0.05mol·L-1)+Ac-(0.02mol·L-1)
=1.76×10-5,反应HAc(1mol·L-1)====H+(0.05mol·L-1)+Ac-(0.02mol·L-1)
A.正反应自发;
B.逆反应自发;
C.处于平衡状态;
D.速率极慢。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
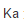 =1.76×10-5,反应HAc(1mol·L-1)====H+(0.05mol·L-1)+Ac-(0.02mol·L-1)
=1.76×10-5,反应HAc(1mol·L-1)====H+(0.05mol·L-1)+Ac-(0.02mol·L-1)A.正反应自发;
B.逆反应自发;
C.处于平衡状态;
D.速率极慢。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知298K时,HAc的离解平衡常数=1.76×10-5,反…”相关的问题
更多“已知298K时,HAc的离解平衡常数=1.76×10-5,反…”相关的问题
298K时,某一电导池充满0.01mol/L的KCl溶液(电导率为0.1411S/m)时,测得其电阻为163Ω。若用同一电导池充满0.01mol/L的NH3.H2O时,测得溶液的电阻为2017Ω。试求该NH3.H2O溶液的电离度和电离平衡常数。(已知该温度下,NH4+和OH-的无限稀释摩尔电导率分别为73.4×10-4S.m2/mol和1.98×10-2S.m2/mol。)
在298K时,NH4HS(s)在一真空瓶中的分解反应为
NH4HS(s)===NH3(g)+H2S(g)
(1)达平衡后,测得总压为66.66kPa,计算标准平衡常数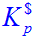 ,设气体为理想气体;
,设气体为理想气体;
(2)若瓶中已有NH3(g),其压力为40.00kPa,计算这时瓶中的总压。
根据下列反应(假设离子浓度均为1.0molL-1) Ni(s)+Sn2+(aq)=Ni2+(aq)+Sn(s) Cl2(g)+2Br-1(aq)=Br2(l)+2Cl-(aq) 试分别计算: (1)它们组成的原电池电动势,并指出正负极。 (2)298K时的平衡常数。 (3)298K反应的标准吉布斯函数变△rGΘm。
某水溶液含有非挥发性溶质,在271.65K时凝固。试求:(1)该溶液的正常沸点;(2)在298K时的蒸气压,已知该温度时纯水的蒸气压为3.178kPa;(3)在298K时的渗透压,假设溶液是理想的稀溶液。
有如下电池
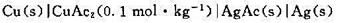
已知298K时该电池的电动势E(298K)=0.372V,温度为308K时,E(308K)=0.374V,设电动势随温度的变化是均匀的。又已知298 K时,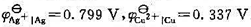 . (1)写出电极反应和电池反应;(2)当电池可逆地输出2mol电子的电荷量时,求电池反应的
. (1)写出电极反应和电池反应;(2)当电池可逆地输出2mol电子的电荷量时,求电池反应的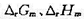 和
和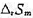 ;(3)求醋酸银AgAc(s)的溶度积
;(3)求醋酸银AgAc(s)的溶度积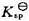 ,设活度因子均为1。
,设活度因子均为1。
298K时,已知NaOH、NaCl和NH4Cl溶液无限稀释时的摩尔电导率分别为248.41×10-4S·m2/mol、126.4×10-4S·m2/mol和149.8×10-4S·m2/mol,试计算该温度下NH3·H2O溶液的无限稀释摩尔电导率。
已知298K时,正辛烷C8H18(g)的标准摩尔燃烧焓为 -5512.4kJ.mol-1,二氧化碳CO2(g)和水H2O(1)的标准摩尔生成焓分别为393.5和-285.8mol-1;正辛烷C8H18(g)、氢气H2(g)和石墨C(s)的标准摩尔熵分别为463.71、130.68和5.74J.K-1.mol-1,计算 (1)298K时C8H18(g)生成反应的
1.jpg) (2)298K及标准压力下该生成反应达到平衡时C8H18(g)的摩尔分数; (3)讨论温度和压力对C8H18(g)生成反应的影响。
(2)298K及标准压力下该生成反应达到平衡时C8H18(g)的摩尔分数; (3)讨论温度和压力对C8H18(g)生成反应的影响。
①2NH₃(g)→N₂(g)+3H₂(g)rHmΘ=92.2kJ·mol—1
②H₂(g)+ 1/2O₂(g)→H₂O(g)rHmΘ=-241.8 kJ·mol-1
③4NH₃(g)+5O₂(g)→4NO(g)+6H₂O(g)rHmΘ=-905。6 kJ·mol-1
试确定fHmΘ(NH₃,g,298K)=()kJ·mol-1;fHmΘ(H₂O,g,298K)=()kJ·mol—1;fHmΘ(NO,g,298K)=()kJ·mol—1。由NH₃(g)生产1.00kgNO(g)则放出热量为()kJ。
在298K时,下述电池的电动势E=0.1519V:
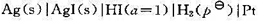
并已知下列物质的标准摩尔生成焓:
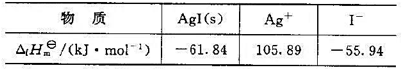
试求:(1)当电池可逆输出1mol电子的电荷量时,Q.W.(膨胀功)、W:(电功)和电池反应的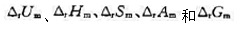 、 和 的值各为多少;(2)如果让电池短路,不做电功,则在发生同样的反应时上述各函数的变量又为多少。
、 和 的值各为多少;(2)如果让电池短路,不做电功,则在发生同样的反应时上述各函数的变量又为多少。
在298K和101 325Pa条件下,配制1000cm3的甲醇(B)水(A)溶液,溶液浓度为xB=0.3。已知该浓度时偏摩尔体积VB,m=38.632ml/mol,vA,m=17.765ml/mol,纯态时摩尔体积VB=40.772ml/mol,VA=18.062ml/mol。 (1)需要纯水和纯甲醇各多少? (2)混合过程体积变化多少?