 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
根据标准电极电势计算298 K时下列电池的电动势及电池反应的平衡常数。 (1)(-)Pb|Pb2+(0.1mol·L-1)||Cu2+(0.
根据标准电极电势计算298 K时下列电池的电动势及电池反应的平衡常数。
(1)(-)Pb|Pb2+(0.1mol·L-1)||Cu2+(0.5mol·L-1)|Cu()
(2)(-)Sn|Sn2+(0.05mol·L-1)||H+(1.0mol·L-1)|H2(105Pa)|Pt()
(3)(-)Pt|H2(105Pa)|H+(1mol·L-1)||Sn4+(0.5mol·L-1),Sn2+(0.1mol·L-1)|Pt()
(4)(-)Pt|H2(105Pa)|H+(0.01mol·L-1)||H+(1.0mol·L-1)|H2(105Pa)|Pt()
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“根据标准电极电势计算298 K时下列电池的电动势及电池反应的…”相关的问题
更多“根据标准电极电势计算298 K时下列电池的电动势及电池反应的…”相关的问题
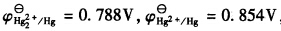 ,试计算:(1)反应Hg2++2e→
,试计算:(1)反应Hg2++2e→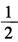 Hg22+的标准电极电势;(2)为反应Hg+Hg2+→Hg22+设计电池,并计算该反应的标准平衡常数。
Hg22+的标准电极电势;(2)为反应Hg+Hg2+→Hg22+设计电池,并计算该反应的标准平衡常数。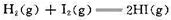

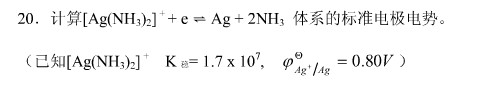
 Au的标准电极电势为1.52 V,若向溶液中加入足够的Cr以形成AuCl4-,当Cl-和AuCl4-的浓度均为1.00 mol.dm-3时,电极电势降为1.00 V。试计算反应Au3++4Cl-
Au的标准电极电势为1.52 V,若向溶液中加入足够的Cr以形成AuCl4-,当Cl-和AuCl4-的浓度均为1.00 mol.dm-3时,电极电势降为1.00 V。试计算反应Au3++4Cl- AuCl4-的配位平衡常数(K稳)。
AuCl4-的配位平衡常数(K稳)。
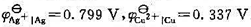 . (1)写出电极反应和电池反应;(2)当电池可逆地输出2mol电子的电荷量时,求电池反应的
. (1)写出电极反应和电池反应;(2)当电池可逆地输出2mol电子的电荷量时,求电池反应的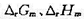 和
和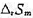 ;(3)求醋酸银AgAc(s)的溶度积
;(3)求醋酸银AgAc(s)的溶度积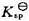 ,设活度因子均为1。
,设活度因子均为1。
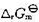 分别为- 40.26kJ·mol-1和-33.02 kJ·mol-1。试问在298 K和100 kPa压力下,
分别为- 40.26kJ·mol-1和-33.02 kJ·mol-1。试问在298 K和100 kPa压力下,















